Дмпп сердца: диагноз и методы лечения дефекта межпредсердной перегородки у новорожденных детей. Врожденный порок сердца при дефекте межпредсердной перегородки
Дата публикации статьи: 15.05.2017
Дата обновления статьи: 21.12.2018
Из этой статьи вы узнаете: что такое дефект межпредсердной перегородки, почему он возникает, к каким осложнениям может привести. Как выявляют и лечат этот врожденный .
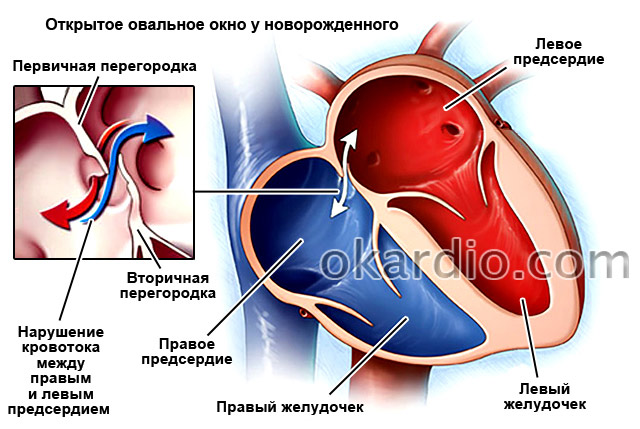
Дефект межпредсердной перегородки (сокращенно ДМПП) – это один из самых частых врожденных пороков сердца, при котором в перегородке, разделяющей правое и левое предсердие, существует отверстие. При этом пороке из левого предсердия кровь, обогащенная кислородом, попадает напрямую в правое предсердие.
В зависимости от размеров отверстия и существования других пороков, эта патология может или не иметь никаких негативных последствий, или приводить к перегрузке правых отделов сердца, и нарушениям сердечного ритма.
Открытое отверстие в межпредсердной перегородке присутствует у всех новорожденных детей, так как оно необходимо для кровообращения у плода во время внутриутробного развития. Сразу же после родов отверстие закрывается у 75% детей, однако у 25% взрослых оно остается открытым.
Пациенты с наличием данной патологии могут не иметь никаких симптомов в детском возрасте, хотя время их появления зависит от величины отверстия. Клиническая картина в большинстве случаев начинает проявляться с увеличением возраста. В возрасте 40 лет 90% людей с этим пороком, которым не проводилось лечение, страдают от одышки при физической нагрузке, усталости, сердцебиения, нарушений сердечного ритма и сердечной недостаточности.
Занимаются проблемой дефекта в межпредсердной перегородке педиатры, кардиологи и кардиохирурги.
Причины патологии
Межпредсердная перегородка (МПП) разделяет левое и правое предсердия. Во время внутриутробного развития в ней есть отверстие, называемое овальным окном, которое позволяет крови переходить из малого круга в большой, минуя легкие. Так как плод в это время получает все питательные вещества и кислород через плаценту от матери – малый круг кровообращения, основная задача которого состоит в обогащении крови кислородом в легких во время дыхания, ему не нужен. Сразу же после рождения, когда ребенок делает свой первый вдох и расправляет легкие, это отверстие закрывается. Однако так случается не у всех детей. У 25% взрослых наблюдается незакрытое овальное окно.
Дефект может появляться во время внутриутробного развития плода и в других частях МПП. У некоторых пациентов его возникновение может быть связано со следующими генетическими заболеваниями:
Однако у большинства пациентов причину появления ДМПП выяснить не удается.
Прогрессирование болезни
У здоровых людей уровень давления в левой половине сердца значительно выше, чем в правой, поскольку левый желудочек прокачивает кровь по всему организму, тогда как правый – лишь через легкие.
При наличии большого отверстия в МПП кровь из левого предсердия сбрасывается в правое – возникает так называемый шунт, или сброс крови слева направо. Этот дополнительный объем крови приводит к перегрузке правых отделов сердца. Без лечения это состояние может вызвать увеличение их размеров и привести к сердечной недостаточности.
Любой процесс, который повышает давление в левом желудочке, может усилить сброс крови слева направо. Это может быть артериальная гипертензия, при которой увеличивается артериальное давление, или ишемическая болезнь сердца, при которой повышается жесткость сердечной мышцы и снижается ее эластичность. Именно поэтому клиническая картина дефекта МПП развивается у людей старшего возраста, а у детей чаще всего эта патология протекает бессимптомно. Усиление шунта крови слева направо повышает давление в правых отделах сердца. Их постоянная перегрузка вызывает увеличение давления в легочной артерии, которое приводит к еще большей перегрузке правого желудочка.
Этот замкнутый круг, если его не разорвать, может привести к тому, что давление в правых отделах превысит давление в левой половине сердца. Это становится причиной возникновения сброса справа налево, при котором в большой круг кровообращения попадает венозная кровь, которая содержит небольшое количество кислорода. Появление шунта справа налево называют синдромом Эйзенменгера, это считается неблагоприятным прогностическим фактором.
Харктерные симптомы
Размер и расположение отверстия в МПП влияет на симптомы этого заболевания. Большинство детей с ДМПП выглядят полностью здоровыми и не имеют никаких признаков болезни. Они нормально растут и набирают вес. Но большой дефект межпредсердной перегородки у детей может привести к появлению следующих симптомов:
- плохой аппетит;
- плохой рост;
- усталость;
- одышка;
- проблемы с легкими – например, пневмония.

Дефекты средних размеров могут не вызывать никаких симптомов, пока пациент не вырастет и не достигнет среднего возраста. Затем могут появиться следующие признаки:
- одышка, особенно во время физической нагрузки;
- частые инфекционные заболевания верхних дыхательных путей и легких;
- ощущение сердцебиения.
Если дефект МПП не лечить, в дальнейшем у пациента могут появиться серьезные проблемы со здоровьем, включая нарушения сердечного ритма и ухудшение сократительной функции сердца. По мере взросления детей с этим заболеванием у них может повышаться риск развития инсульта, так как тромбы, которые образуются в венах большого круга кровообращения, могут проходить через отверстие в перегородке из правого предсердия в левое и попадать в мозг.
Также со временем у взрослых пациентов с нелеченым большим дефектом в МПП может развиться легочная гипертензия и синдром Эйзенменгера, проявляющиеся:
- Одышкой, которая сперва наблюдается при физической нагрузке, а со временем и в состоянии покоя.
- Усталостью.
- Головокружениями и обмороками.
- Болью или ощущением сдавливания в грудной клетке.
- Отеками на ногах, асцитом (накопление жидкости в брюшной полости).
- Синеватым цветом губ и кожи (цианоз).
У большинства детей с дефектом МПП болезнь обнаруживают и лечат задолго до того, как возникают симптомы. Из-за осложнений, возникающих во взрослом возрасте, детские кардиологи часто рекомендуют закрывать это отверстие в раннем детстве.
Диагностика
Дефект в межпредсердной перегородке может быть обнаружен во время внутриутробного развития или после рождения, а иногда и в зрелом возрасте.
Во время беременности проводятся специальные скрининговые обследования, целью которых является раннее обнаружение различных пороков развития и заболеваний. Наличие дефекта в МПП можно выявить с помощью ультразвукового исследования, создающего изображение плода.
 Ультразвуковое исследование сердца плода
Ультразвуковое исследование сердца плода
После рождения ребенка обычно педиатр при осмотре обнаруживает сердечный шум, вызванный током крови через отверстие в МПП. Наличие этого заболевания не всегда удается выявить в раннем возрасте, как другие врожденные пороки сердца (например, дефект в перегородке, разделяющей правый и левый желудочек). Вызванный патологией шум – тихий, его услышать труднее, чем другие виды сердечных шумов, из-за чего это заболевание может быть выявлено в подростковом возрасте, а иногда и позже.
Если врач слышит и подозревает наличие врожденного порока, ребенка направляют к детскому кардиологу – врачу, который специализируется на диагностике и лечении детских сердечных заболеваний. При подозрении на дефект в межпредсердной перегородке он может назначить дополнительные методы обследования, включая:
- Эхокардиографию – обследование, состоящее в получении изображения структур сердца в режиме реального времени с помощью ультразвука. Эхокардиография может показать направление кровотока через отверстие в МПП и измерить его диаметр, а также оценить, сколько крови через него проходит.
- Рентгенографию органов грудной полости – это диагностический метод, использующий рентгеновские лучи для получения изображения сердца. Если у ребенка есть дефект в МПП, сердце может быть увеличено в размерах, так как правые отделы сердца вынуждены справляться с увеличенным количеством крови. Вследствие легочной гипертензии развиваются изменения в легких, которые можно обнаружить с помощью рентгенографии.
- Электрокардиография (ЭКГ) – запись электрической активности сердца, с помощью которой можно обнаружить нарушения сердечного ритма и признаки увеличенной нагрузки на его правые отделы.
- Катетеризация сердца – это инвазивный метод обследования, дающий очень детальную информацию о внутреннем строении сердца. Через кровеносный сосуд в паху или на предплечье заводится тонкий и гибкий катетер, который осторожно направляется внутрь сердца. Во всех сердечных камерах, аорте и легочной артерии измеряется давление. Для получения четкого изображения структур внутри сердца внутрь него вводится контрастное вещество. Хотя иногда достаточное количество диагностической информации можно получить с помощью эхокардиографии, во время катетеризации сердца можно закрыть дефект МПП с помощью специального устройства.
 Методы диагностики дефекта межпредсердной перегородки
Методы диагностики дефекта межпредсердной перегородки
Методы лечения
После выявления дефекта МПП выбор метода лечения зависит от возраста ребенка, размеров и расположения отверстия, тяжести клинической картины. У детей с очень маленьким отверстием оно может закрыться самостоятельно. Более крупные дефекты сами обычно не закрываются, поэтому их нужно лечить. Большинство из них можно устранить малоинвазивным путем, хотя при некоторых ДМПП необходимо проведение открытой операции на сердце.
Ребенку с небольшим отверстием в МПП, которое не вызывает никаких симптомов, может понадобиться только регулярно посещать детского кардиолога, чтобы убедиться в том, что не появилось никаких проблем. Часто эти маленькие дефекты закрываются сами по себе, без проведения какого-либо лечения, в течение первого года жизни. Обычно у детей с маленькими дефектами в МПП нет никаких ограничений в физической активности.
Если в течение года отверстие в МПП не закрылось само, врачам часто приходится устранять его до достижения ребенком школьного возраста. Это проводится тогда, когда дефект имеет крупные размеры, сердце увеличено в размерах или появились симптомы болезни.
Малоинвазивное эндоваскулярное лечение
До начала 1990-х годов открытые операции на сердце были единственным методом закрытия всех дефектов МПП. Сегодня, благодаря достижениям медицинских технологий, врачи для закрытия некоторых отверстий в МПП используют эндоваскулярные процедуры.
Во время такой малоинвазивной операции врач вводит тонкий и гибкий катетер в вену в паху и направляет его в сердце. Этот катетер содержит подобное зонту устройство в сложенном состоянии, которое называют окклюдером. Когда катетер достигает МПП, окклюдер выталкивают из катетера и закрывают им отверстие между предсердиями. Устройство закрепляют на месте, а катетер извлекают из тела. В течение 6 месяцев над окклюдером растет нормальная ткань.

Для точного направления катетера к отверстию врачи используют эхокардиографию или ангиографию.
Эндоваскулярное закрытие дефекта МПП намного легче переносится пациентами, чем открытые операции на сердце, поскольку для их проведения необходима лишь пункция кожи в месте введения катетера. Благодаря этому облегчается восстановления после вмешательства.
Прогноз после такого лечения прекрасен, оно успешно у 90% пациентов.
Открытые операции на сердце
Иногда дефект в МПП невозможно закрыть эндоваскулярным методом, в таких случаях проводят открытые операции на сердце.
Во время хирургического вмешательства кардиохирург делает большой разрез в грудной клетке, достигает сердца и ушивает отверстие. Во время операции пациент находится в условиях искусственного кровообращения.
Прогноз при открытых операциях на сердце по закрытию дефекта МПП прекрасен, осложнения развиваются очень редко. Пациент проводит в лечебном учреждении несколько дней, затем выписывается домой.
Послеоперационный период
После закрытия дефекта в МПП пациенты наблюдаются кардиологом. Медикаментозная терапия им нужна редко. Врач может проводить наблюдение с помощью эхокардиографии и ЭКГ.
После открытой операции на сердце основное внимание уделяется заживлению разреза грудной клетки. Чем моложе пациент, тем быстрее и легче проходит процесс восстановления. Если у больного появились одышка, повышенная температура тела, покраснение около послеоперационной раны или выделения из нее, следует немедленно обратиться за медицинской помощью.
Пациентам, которым проводилось эндоваскулярное лечение ДМПП, нельзя посещать спортзал или выполнять какие-то физические упражнения в течение недели. Спустя это время они могут вернуться к своему обычному уровню активности, проконсультировавшись перед этим с врачом.
Обычно дети после операции восстанавливаются очень быстро. Но и у них могут возникать осложнения. Немедленно обратиться за медицинской помощью следует в случае появления следующих симптомов:
- Одышка.
- Синий цвет кожи на губах.
- Ухудшение аппетита.
- Отсутствие увеличения веса или его снижение.
- Сниженный уровень активности у ребенка.
- Длительное повышение температуры тела.
- Выделения из послеоперационной раны.
Прогноз
У новорожденных небольшой дефект межпредсердной перегородки часто не вызывает никаких проблем, иногда закрывается без какого-либо лечения. Большие отверстия в МПП часто требуют эндоваскулярного или хирургического лечения.
Важными факторами, влияющими на прогноз, являются размер и расположение дефекта, величина кровотока через него, наличие симптомов болезни.
При своевременном проведении эндоваскулярного или хирургического закрытия дефекта прогноз прекрасный. Если этого не сделать, у людей с большим отверстием в МПП повышается риск развития:
- нарушений сердечного ритма;
- сердечной недостаточности;
- легочной гипертензии;
- ишемического инсульта.
Дефект вторичной части межпредсердной перегородки может быть признаком ряда генетических заболеваний - синдрома Эллиса-Ван Кревельда, синдрома Нунан, синдрома Гольденхара, синдрома Кабуки, синдрома Вильямса и ряда хромосомных аномалий (трисомия 13, 18, 21-й пары, делеции хромосом 1, 4, 4p, 5p, 6, 10p, 11, 13, 17, 18, 22).
Некоторые заболевания матери (диабет, фенилкетонурия, острые лихорадочные болезни во время беременности), а также тератогенные воздействия на плод (антиконвульсанты, алкоголь, нестероидные противовоспалительные препараты) повышают риск возникновения ДМПП.
Причины дефекта перегородки:
В период эмбриогенеза межпредсердная перегородка закладывается из двух тканевых гребней. Один из них растет вверх от области первичного атриовентрикулярного соединения [согласно концепции Van Praagh и Сorsini - от участка левого венозного клапана (sinus venosus)] и называется первичной частью перегородки (septum primum) (нижняя треть перегородки). Он растет из задней части предсердия и затем встречается со вторичной частью перегородки. Вторичная часть (septum secundum) в виде гребня растет от основания сердца (верхней части предсердий) вниз. Между ними в средней трети перегородки находится овальная ямка, и в период внутриутробного развития в этой области функционирует овальное окно, которое является обязательным компонентом нормального внутриутробного кровообращения. Спонтанное закрытие овального окна происходит в первые недели либо месяцы жизни у большинства новорожденных, и обнаружение небольшого отверстия в области овальной ямки в этом возрасте не является основанием для постановки диагноза ДМПП.Дефекты предсердной перегородки представляют собой не закрывшиеся самостоятельно естественные отверстия МПП, возникшие в период закладки органов, либо как крайний вариант - полное недоразвитие одного из ее зачатков.
Типы межпредсердных дефектов:
Дефект вторичной части МПП составляет 80-90% всех ДМПП и локализуется в области овальной ямки либо верхней части перегородки, создавая шунт из левого предсердия в правое. Такой дефект возникает преимущественно из-за избыточной фенестрации или резорбции первичной части перегородки либо недоразвития вторичной части перегородки, а также при сочетании этих факторов. Примерно в 10% случаев ему сопутствует частичный аномальный дренаж легочных вен. ДМПП означает наличие истинной недостаточности ткани предсердной перегородки с сохранением функциональной и анатомической проходимости дефекта. Дефекты вторичной части предсердной перегородки часто называют вторичными ДМПП. Подобные дефекты не следует путать с незаращением овального отверстия. Анатомическая облитерация овального окна, как правило, следует за его функциональным закрытием вскоре после рождения.Дефект вторичной части перегородки может сочетаться с аневризмой МПП. Предположительно это является результатом избыточности ткани клапана овального окна. В таких случаях возможно сочетание с пролапсом митрального клапана и предсердными аритмиями.
К разновидностям дефекта вторичной части МПП также относятся редко встречающиеся дефекты: дефекты венозного синуса (unroofed coronary sinus), которые встречаются редко и составляют 3-4% всех ДМПП. Они располагаются в области соединения МПП с верхней полой веной и значительно реже - в месте впадения нижней полой вены в правое предсердие. При этих дефектах часть крыши коронарного синуса отсутствует, и поэтому кровь шунтируется из левого предсердия в коронарный синус и затем в правое предсердие. Дефекты венозного синуса, возникающие в верхней части МПП вблизи впадения верхней полой вены, нередко сопровождаются аномальным соединением легочных вен, исходящих из правого легкого с верхней полой веной и правым предсердием. Правые легочные вены могут аномально дренироваться в ПП, чаще у места впадения верхней полой вены (впадение правых легочных вен в нижнюю полую вену называется синдромом ятагана).
Дефект первичной части МПП, локализующийся в нижней ее трети. Аномалии типа первичного отверстия представляют собой разновидность дефекта развития эндокардиальных подушечек. Такие дефекты локализуются непосредственно рядом с атриовен-трикулярными клапанами, которые могут быть деформированы и некомпетентны в отношении выполнения своей функции, а иногда они образуют общий предсердно-желудочковый клапан.
Под термином «синдром Лютембаше» описывают редкую комбинацию ДМПП и стеноза левого атриовентрикулярного отверстия (митрального стеноза). Последний развивается как следствие приобретенного ревматического вальвулита.
В число регистрируемых ДМПП не входит открытое овальное окно (дефект в области овальной ямки размером до 0,2 см), которое встречается у 15-30% взрослых и не сопровождается расстройствами гемодинамики, по этой причине не требует лечения и не влияет на продолжительность жизни.
Гемодинамические расстройства
Объем шунтирования крови через межпредсердный дефект зависит от размера дефекта, сосудистого сопротивления в большом и малом круге кровообращения, податливости желудочков. В первые месяцы жизни левый и правый желудочки имеют одинаковую толщину стенки и поэтому одинаково растяжимы в диастоле, вследствие чего сброс слева направо невелик. Позже податливость ПЖ возрастает по мере снижения постнагрузки на него из-за уменьшения легочного сосудистого сопротивления, сброс слева направо через шунт увеличивается и возникает дилатация ПП и ПЖ. Величина сброса крови слева направо через ДМПП зависит от размеров дефекта, относительной податливости желудочков и величин сосудистого сопротивления легочного и системного круга кровообращения.
При небольшом ДМПП давление в левом предсердии превышает давление в правом на несколько миллиметров ртутного столба, тогда как при большом межпредсердном дефекте давления в предсердиях могут стать равными. Шунт крови слева направо приводит к диастолической перегрузке правого желудочка и повышению легочного кровотока. Сопротивление сосудов легких у детей с ДМПП обычно нормальное или понижено, а объемная нагрузка хорошо переносится, хотя легочный кровоток может превышать системный в 3-6 раз. Тем не менее у большинства детей с вторичным ДМПП нет никаких субъективных симптомов. Гиперволемия приводит к легочной гипертензии, но она в течение длительного времени выражена умеренно, а необратимые (обструктивные) изменения легочных сосудов при этом пороке формируются обычно не ранее 2-3-го десятилетия жизни. Во время беременности в связи с возрастанием общего объема плазмы объем шунта на уровне предсердий может значительно увеличиться.
Срок появления симптомов:
Хотя порок существует с рождения, шум появляется спустя несколько месяцев либо не выслушивается совсем. В связи с частым отсутствием шума в сердце и симптомов застойной сердечной недостаточности порок обычно распознают при скрининговых эхокардиографических исследованиях, реже - по транзиторному дистальному цианозу и иногда по парадоксальным тромбоэмболиям.Симптомы дефекта межпредсердной перегородки:
Клиническая картина зависит от возраста больного, размеров дефекта, величины сосудистого сопротивления легких. Большинство пациентов с этим пороком выглядят здоровыми, и родители не предъявляют никаких жалоб. Признаками умеренного сброса крови слева направо могут быть непереносимость повышенной физической нагрузки и утомляемость. В большинстве случаев при аускультации нет шума в сердце, иногда даже при большом ДМПП, поскольку разница давлений между левым и правым предсердием невелика и небольшой градиент на участке сброса не создает слышимого звука. I тон обычно нормальный, иногда может быть расщеплен. Значительное увеличение объема крови, текущей через клапан легочного ствола, приводит к возникновению среднесистолического шума изгнания (так называемому гемодинами-ческому стенозу легочной артерии) во втором и третьем межреберьях слева от грудины. Обычно выслушивается отчетливое и не связанное с дыханием расщепление II тона либо усиление II тона над легочной артерией. Симптомов застойной СН чаще нет, либо они выражены умеренно.При межпредсердном дефекте часто встречается пролапс митрального клапана. Причиной этого может быть компрессия левых отделов сердца из-за увеличения правых. У таких пациентов с ПМК выслушивается голосистолический либо позднесистолический шум на верхушке, часто иррадиирующий в аксиллярную область; может быть слышен среднесистолический клик.
Иногда при очень больших размерах дефекта наблюдаются одышка, тахикардия, гепатомегалия, может появиться сердечный горб, границы сердца расширены вправо, усилена пульсация ПЖ желудочка и может пальпаторно определяться пульсация легочной артерии. В этих случаях не только ПЖ, но и легочная артерия значительно дилатированы, поэтому гемодинамический стеноз клапана ЛА сменяется его недостаточностью и появляется диастолический шум Грэхема-Стилла (шум относительной гемодинамической недостаточности клапана легочной артерии во втором и третьем межреберьях слева от грудины).
У пациентов с общим предсердием наблюдается право-левое шунтирование и цианоз, хотя он обычно выражен слабо.
Тяжелая сердечная недостаточность редко развивается при вторичном ДМПП, лишь у 3-5% больных, и только при очень большом размере дефекта, особенно если это дефект типа венозного синуса (sinus venosus). В этой небольшой группе больных серьезная СН и задержка физического развития возникают в возрасте до 1 года (в половине этих случаев из-за гемодинамических расстройств и еще в половине - из-за сочетанной органной недостаточности вследствие сопутствующих пороков развития). В этой маленькой группе летальность достигает 10%, если не выполнена операция.
Очень редко первым симптомом межпредсердного дефекта бывает эмболический инсульт.
При нераспознанном ДМПП симптомы сердечной недостаточности могут впервые появиться во время беременности в связи с возрастанием объема циркулирующей крови.
Диагностика
На фронтальной рентгенограмме грудной клетки при небольших и средних размерах дефекта изменений может не быть. При больших дефектах возникает усиление легочного рисунка, расширение границ сердечной тени из-за дилатации ПП, ПЖ; легочная артерия расширена и выбухает слева между контуром аорты и ЛЖ.
На электрокардиограмме при небольших дефектах нет изменений. При дефекте большого размера электрическая ось имеет вертикальное положение или отклонена вправо (+95 ... +170?). Если объем шунтирования слева направо составляет более 50% минутного объема малого круга кровообращения, появляются признаки гипертрофии ПЖ и ПП (rsR морфология в V1, подчеркнутый S-зубец в левых грудных отведениях, отсутствие зубца Q в левых грудных отведениях, остроконечный Р-зубец). При любом типе дефекта, особенно при дефекте венозного синуса, может быть удлинен интервал P-R. У более старших детей появляются предсердные аритмии (наджелудочковая экстраси-столия и тахикардия, трепетание предсердий).
Лабораторные данные - общий анализ крови и газовый состав крови в норме.
При допплерэхокардиографии определяются локализация и размер дефекта, направление сброса крови через него, дилатация ПП и ПЖ, ствола ЛА.
Дополнительно при большом дефекте МПП определяются парадоксальное движение МЖП, признаки трикуспидальной регургитации II-III степени, повышение давления в правом желудочке и легочной артерии. При чреспищеводной эхокардиографии могут быть выявлены аномалии легочных вен, ассоциированных с межпредсердным дефектом типа situs venosus.
Катетеризация сердца и ангиокардиография:
Требуется очень редко, в тех случаях, когда наблюдается несоответствие клинических симптомов порока данным инструментальных исследований. В основном применяется с целью оценки степени легочной гипертензии, если она выражена, наличия легочно-системного шунтирования и оценки резистентности легочного сосудистого русла.Естественная эволюция порока
Без оперативного лечения легочная гипертензия прогрессирует, но появление обструктивного поражения сосудов легких (ЛГ III-IV степени) наблюдается со 2-3-го десятилетия жизни, т.е. позже, чем при ДМЖП и ОАП. При нераспознанном межпредсердном дефекте у подростков и взрослых присоединение артериальной гипертензии увеличивает объем лево-правого сброса. В поздней стадии порока происходит значительный рост резистентности сосудов малого круга, что в подростковом возрасте либо после 18 лет приведет к обструктивному поражению сосудов легких и снижению степени лево-правого шунта.Кроме того, из-за дилатации ПП возникают стойкие предсердные аритмии (в том числе мерцательная аритмия). Вследствие серьезной дилатации ПП пациентам угрожают тромбоэмболические осложнения (в первую очередь инсульт). Перечисленные причины ограничивают качество и продолжительность жизни. Правожелудочковая застойная сердечная недостаточность при больших размерах дефекта усиливается во время беременности и может привести к неблагоприятному исходу.
Примерно у 15% больных с дефектами вторичной части перегородки небольшого или среднего размера эти дефекты могут закрыться спонтанно к 4-5 годам жизни либо уменьшиться в размерах настолько, что становятся гемодинамически незначимыми.
Наблюдение до операции
При признаках СН и ЛГ назначаются диуретики и ингибиторы АПФ, при необходимости также дигоксин.
Сроки оперативного лечения:
Показаниями к операции в возрасте до 1 года являются симптомы серьезной сердечной недостаточности и задержка физического развития. Для остальных пациентов оптимальный возраст операции - 2-3 года, даже если симптомов нет или они минимальны.Виды оперативного лечения:
Первую успешную операцию ушивания вторичного ДМПП выполнил 2 сентября 1952 г. хирург F. Lewis в клинике медицинского университета штата Миннесота (США) у 5-летней девочки с большим межпредсердным дефектом в условиях общей гипотермии с периодом пережатия аорты менее 6 мин. Ребенок выздоровел без осложнений и без применения современных методов послеоперационной интенсивной терапии и был выписан из госпиталя через 11 дней. Именно по поводу ДМПП проведена первая в мире операция с использованием искусственного кровообращения, когда врач J. Gibbon 6 мая 1953 г. применил созданный им насосный оксигенатор при закрытии ДМПП.В зависимости от размеров и морфологического типа дефекта в настоящее время применяются следующие операционные методики.
Ушивание либо пластика дефекта в условиях искусственного кровообращения из доступа методом срединной стернотомии либо из правосторонней передней торакотомии.
Окклюзия устройством Амплатцера при правильной форме дефекта и наличии у него окружающего края не менее 0,5 см. Попытки кате-терной окклюзии межпредсердного дефекта начались с 1950-х гг., когда различными устройствами пробовали закрыть дефект без применения искусственного кровообращения. В середине 1970-х гг. доктора Т. King и N Mills запатентовали открытое ими устройство, которое позволяет лечить ДМПП с помощью мини-инвазивной транскатетерной манипуляции без операции с искусственным кровообращением. Т. King также впервые произвел эту манипуляцию при межпредсердном дефекте. В течение последних двух десятилетий произошли значительные изменения в подходах к лечению этого порока - внедрено транскатетерное закрытие вторичного межпредсердного дефекта у значительной части взрослых пациентов и детей. За прошедшие более чем 30 лет были испытаны многие разновидности окклюзирующих устройств. Окклюдер для закрытия ДМПП изготавливается в настоящее время в виде одиночного либо двойного диска из различных материалов и с разными видами катетеров, доставляющих устройство в сердце через магистральные вены.
Транскатетерное закрытие ДМПП во вторичной части применяется в мире и у маленьких детей массой менее 10 кг. Недавно в США началось применение биоабсорбирующих-ся окклюдеров у пациентов в возрасте 2,5-13 лет с хорошим результатом на протяжении 6-12 мес наблюдения. Эти окклюдеры (BioSTAR) относятся к биоинженерным устройствам - они изготовлены из высоко-очищенного ацеллюлярного матрикса, содержащего в своей основе на-тивный интерстициальный коллаген. Технические правила установки и последующего наблюдения биодеградирующих окклюдеров идентичны таковым при установке обычных окклюдеров Амплатцера, за исключением последующей постепенной биодеградации устройства с заменой собственной фиброзной тканью.
При кажущейся простоте этой процедуры существует ряд факторов, влияющих как на возможность, так и на успех ее выполнения. К ним относятся морфологические особенности дефекта, наличие сопутствующих заболеваний, а также ряд индивидуальных признаков, таких как возраст, рост, масса тела. Осложнения встречаются менее чем у 1% больных, к ним относятся перфорация стенки сосуда, сосудистые тромбозы, смещение окклюдером.
Дилатация ПЖ регрессирует с примерно одинаковой скоростью при обеих хирургических техниках. Время пребывания в больнице заметно меньше при транскатетерной процедуре, и реабилитация после выписки короче.
Результат оперативного лечения:
Ранняя операция наиболее эффективна, а при поздно выполненной могут длительно сохраняться уже возникшие до операции легочная ги-пертензия, дилатация правого предсердия и предсердные аритмии.При открытой операции (с искусственным кровообращением) хирургическая летальность не более 0,1%. Осложнения (СССУ, АВ-бло-када) встречаются редко.
При катетерной окклюзии дефекта устройством Амплатцера осложнения встречаются у 3-4% пациентов (эмболии, перфорация стенки сосудов либо сердца, тампонада сердца, аритмии, окклюзии сосудов, неполное закрытие дефекта, резидуальный шунт, неправильное положение устройства со смещением атриовентрикулярных клапанов). Летальность вследствие указанных осложнений менее 1%.
Особенности закрытия ДМПП у детей раннего возраста:
При изолированном ДМПП у пациентов нередко нет клинических симптомов в младенческом возрасте и раннем детстве, поэтому оперативное вмешательство обычно может быть отложено до возраста 2- 4 лет. Однако хорошо известно, что существует небольшая часть детей младшего возраста с ДМПП, требующих более ранней хирургической интервенции, если порок сочетается с хроническими заболеваниями легких либо некоторыми хромосомными аномалиями.В последние годы появляется все больше сообщений об успешном результате транскатетерного закрытия ДМПП даже у детей с массой тела менее 10 кг, с низким числом осложнений. Тем не менее следует помнить, что узкий просвет сосудов, через которые проводится сравнительно ригидный проводник, несущий устройство Амплатцера, влечет за собой более значимый риск сосудистого повреждения, чем у старших детей. Младенцы также имеют более высокий риск повреждения сердца при данной манипуляции. Наследственный тип ДМПП обычно сопровождается относительно малой шириной предсердного края вокруг дефекта, что может помешать установке окклюдера с маленькими дисками либо приведет к эрозии перегородки или необходимости прекращения процедуры.
Из-за маленького размера перегородки попытка установки окклюде-ра может быть неудачной и в связи с дефицитом ткани по краю дефекта, необходимой для фиксации устройства около митрального клапана. Таким образом, чтобы убедиться в безопасности транскатетерной окклюзии, необходимо тщательно оценить все указанные факторы и желательно также обладать опытом выполнения подобных процедур у младенцев. Для больных раннего возраста предложена в настоящее время индивидуальная техника подбора левопредсердного диска.
Кардиохирург
Высшее образование:
Кардиохирург
Кабардино-Балкарский государственный университет им. Х.М. Бербекова, медицинский факультет (КБГУ)
Уровень образования - Специалист
Дополнительное образование:
Сертификационный цикл по программе «Клиническая кардиология»
Московская медицинская академия им. И.М. Сеченова
Врожденные пороки сердца (ВПС) – не такое уж редкое явление. Статистика сообщает, что в России ежегодно рождается от 0,8 до 1% младенцев с той или иной аномалий развития сердца и аорты. Но далеко не все пороки несут опасность для жизни. Современная кардиохирургия способна спасти жизнь многим новорожденным даже с очень сложными ВПС. Дефект межпредсердной перегородки (ДМПП) – это порок сердца, с которым человек может дожить до пожилого возраста. Но только тогда, когда дефект очень мал или при своевременно сделанной операции по его коррекции.
Анатомия порока
В здоровом сердце взрослого человека предсердия полностью изолированы друг от друга. Левое принимает кровь из легких, обогащенную кислородом и готовую к доставке ко всем органам. В правом предсердии находится венозная кровь с очень небольшим содержанием кислорода. При ВПС ДМПП, когда между предсердиями есть патологическое отверстие, происходит перемещение крови из левого предсердия в правое.
Чем грозит подобная аномалия? Правая часть сердца отвечает за перекачку крови в легкие, чтобы она насытилась кислородом. При забросе дополнительного количества крови происходит перегрузка легочных сосудов. Лишний объем крови может вызывать сердечную недостаточность и рост давления в легочной артерии (легочную гипертензию).
Виды ДМПП
Врожденный порок сердца в виде дефекта межпредсердной перегородки имеет несколько разновидностей. По величине отверстия различают:

- малое отверстие – дефект, который не наносит ущерба работе сердца и имеет бессимптомное течение;
- средний размер отверстия чаще выявляется у подростков и взрослых;
- большой порок имеет явные признаки и диагностируется сразу после рождения.
Дефект межпредсердной перегородки имеет следующую классификацию по характеру:
- первичный может достигать 5 см и возникает из-за недоразвития первичной предсердной перегородки;
- вторичный означает недоразвитость вторичной перегородки и обычно имеет отверстие в 1 – 2 см;
- перегородка полностью отсутствует, такой порок еще называют трехкамерным сердцем – 2 желудочка и одно общее предсердие.
По местоположению порок может быть:
- центральным;
- верхним;
- нижним;
- задним;
- передним.
Внутриутробный кровоток плода не затрагивает легкие, а идет только через сердце. Проход между предсердиями необходим для нормальной жизнедеятельности будущего ребенка. Это физиологическое отверстие называется овальное окно. После того, как у родившегося младенца устанавливается кровообращение через легкие, овальное окно закрывается. Его не относят к врожденным порокам сердца.
Изолированный ДМПП занимает по частоте второе место после ДМПЖ (дефекта межжелудочковой перегородки), а вот в сложных пороках его частота составляет до 50%. Еще одной его особенностью является то, что он в большинстве случаев идет в сопровождении других пороков развития. Это может быть заячья губа, врожденные дефекты почек или синдром Дауна.
Симптомы
Симптоматика ДМПП зависит от величины патологического отверстия и может развиваться почти сразу после рождения или не давать о себе знать до глубокой старости.
Что происходит при большом ДМПП?
У ребенка с таким пороком клиническая картина становится ясной через несколько дней после рождения. Из-за излишка крови в легочной артерии в легких начинается застой жидкости, вследствие чего происходит инфицирование и развивается пневмония. Внешне эти изменения проявляются следующими симптомами:
- затруднение дыхания в покое;
- бледная или синюшная кожа;
- учащенное сердцебиение;
- беспокойство.
Такие детки плохо едят и мало прибавляют в весе. Им необходимо делать глубокие вдохи, из-за чего они постоянно отрываются от еды и давятся грудным молоком.
Детям с большим ДМПП показана операция. Причем лучшим моментом для нее считается так называемый период стабилизации. После первых проявлений порока сосуды сужаются, и наступает временной промежуток, когда все симптомы легочной гипертензии проходят. Ребенок выглядит и чувствует себя здоровым.

При отказе от операции впоследствии начинается необратимое склерозирование сосудов. Чтобы компенсировать давление мышечные ткани камер сердца, сосудов и артериол уплотняются и теряют эластичность. Ребенка страдает от артериальной гипоксимии – снижения содержания кислорода в крови.
Средний и малый порок
Средний дефект межпредсердной перегородки проявляется в детстве. Его начальные симптомы схожи с признаками большого дефекта и выражаются в проявлениях сердечной недостаточности. Но при среднем пороке они менее выражены. Дети хуже растут и отстают в развитии от своих здоровых сверстников.
К 3 — 4 годам могут развиться следующие симптомы:
- частые носовые кровотечения;
- головокружения;
- синюшность кончиков пальцев и носа, ушей, губ;
- обмороки;
- полная непереносимость физической активности;
- сердечные боли;
- сердцебиение;
- затруднение дыхания в покое.
В дальнейшем к подростковому возрасту состояние будет усугубляться сбоями сердечного ритма, формированием пальцев с утолщением ногтевой фаланги (барабанные палочки). При обследовании у них вероятно обнаружение увеличения селезенки и печени, тахикардия, хрипы при дыхании, говорящие о застое.
Малый дефект межпредсердной перегородки не проявляет себя никакими признаками, особенно в раннем детстве. Совсем маленькие отверстия могут постепенно закрываться. Если этого не происходит, то будучи уже в подростковом возрасте или во взрослом состоянии человек может чувствовать слабость, одышку при физических нагрузках, быстро уставать.

Поздние проявления ДМПП
Дефект межпредсердной перегородки, если он не был прооперирован в раннем возрасте, дает серьезные осложнения и может представлять угрозу для жизни больного. Самым распространенным осложнением является легочная гипертензия. Повышенное давление приводит к застою жидкости в легких. В редких случаях оно может вызвать синдром Эйзенменгера – органические изменения в легких. Среди других осложнений чаще всего встречаются:
- сердечная недостаточность, особенно правого предсердия и желудочка;
- нарушения сердечного ритма;
- инсульт.
При не оперированном пороке продолжительность жизни снижается до 35 – 40 лет.
Причины
Точно установить причины происхождения врожденных пороков невозможно. Поэтому врачи говорят о факторах, которые повышают риск их развития. К одним из главных относится генетическая предрасположенность. Вероятность развития аномалии многократно возрастает, если у ближайших родственников наблюдались ВПС. Планируя беременность, таким семьям желательно пройти генетическую экспертизу, которая установит степень риска отклонения внутриутробного развития плода. К другим – внешним – факторам относят:
- вирусные заболевания (в частности, краснуху), перенесенные во время беременности;
- алкоголь во время беременности;
- прием во время вынашивания ребенка нестероидных противовоспалительных препаратов и некоторых других медикаментов.

Также причиной может служить сахарный диабет и фенилкетонурия у матери.
Диагностика
Если родители замечают у ребенка хотя бы один из указанных симптомов или видят, что он становится капризным, часто плачет и не хочет играть в другими детьми, им необходимо обратиться к педиатру. Осмотр, анализ жалоб и сбор анамнеза позволит врачу принять решение о дальнейшем специальном обследовании ребенка. Первые признаки в виде шумов в сердце слышны при аускультации. Последующие обследования:
- ультразвуковое исследование сердца (эхокардиография);
- рентген грудной клетки, когда видно характерное расширение отделов сердца;
- пульсоксиметрия устанавливает насколько кровь насыщена кислородом;
- введение в сердце специального катетера с контрастом, при помощи которого устанавливается состояние тканей и структур сердца;
- МРТ – послойный снимок сердца, является наиболее достоверным методом исследования.
Прежде чем направить больного на функциональную диагностику, врач назначает проведение биохимического и общего анализа крови.
Лечение
Консервативное лечение ДМПП возможно только в случаях малых и средних пороков. Оно симптоматическое и позволяет справляться организму с осложнениями. Среди назначаемых препаратов – лекарства, уменьшающие свертываемость крови (антикоагулянты) и регулирующие сердечный ритм (бета-блокаторы, дигоксин). В детском возрасте при малых изолированных пороках врачи ограничиваются наблюдением.
Хирургическое вмешательство – это единственный способ избавить пациента от дефекта межпредсердной перегородки. Врачи рекомендуют делать операцию в детском возрасте. Она может проводиться двумя способами – щадящим с помощью катетера и операцией на открытом сердце. Ранняя операция существенно продлит и повысит качество жизни пациента.
Закрытая операция проводится через бедренную артерию. С помощью зонда к перегородке доставляется специальная сетка, которая перекрывает отверстие в ней. После операции она постепенно зарастает собственной тканью и дефект устраняется. Восстановительный период после эндоваскулярной (закрытой) операции составляет всего несколько дней. После нее редко наблюдаются осложнения. Они могут касаться:
- воспаления и инфицирования в месте введения зонда;
- аллергии на контрастное вещество, которое вводится для рентгеновского контроля операции;
- возникновения болей в месте введения катетера;
- травмы сосуда.
При открытой операции сердце останавливается, и пациент подключается к системе искусственного кровообращения. Заплата на межпредсердную перегородку формируется из ткани перикарда больного или закрывается специальным синтетическим материалом. При операции на открытом сердце необходим длительный период реабилитации – не менее 1 месяца. После операции пациенту придется пожизненно наблюдаться у кардиолога.
В случае отказа от хирургического лечения примерно четверть больных погибает. Прогноз для пациентов, которым сделана операция, благоприятный. Большинство из них благополучно доживают до старости.
У детей с врожденными пороками сердца примерно в 6-10% случаев встречаются единичные или множественные отверстия на перегородке, которая находится между двумя предсердиями сердца. Это заболевание называется «дефект межпредсердной перегородки», и оно приводит к патологическому сбросу крови влево, постепенному развитию нарушений гемодинамики и развитию сердечной недостаточности и легочной гипертензии.
Особенности заболевания
Предсердная перегородка формируется у плода во время его внутриутробного развития. Она закладывается из двух гребней, один из которых растет вверх от атриовентрикулярного соединения (первичная часть перегородки — ее нижняя треть), второй — от основания сердца вниз. Примерно в середине перегородки находится овальная ямка, которая у плода не закрыта и представляет собой окно — естественный компонент кровообращения во время внутриутробного развития ребенка. У новорожденных закрытие овального окна происходит в первые недели после появления на свет. Если же закрытия не произошло, ставится диагноз «дефект предсердной перегородки».
До 10% среди всех ВПС принадлежит именно дефектам межпредсердной перегородки (ДМПП), причем этот порок является самостоятельным (изолированным). Что касается сочетанных, сложных ВПС, то в таких случаях ДМПП соседствует с другими нарушениями строения сердца уже у 30-35% детей с пороками. В большинстве случаев он ассоциируется с такими ВПС и другими врожденными заболеваниями сердечно-сосудистой системы:
- стеноз легочной артерии;
- недостаточность митрального или трикуспидального клапана;
- аномалии развития легочных вен;
- коарктация аорты;
- открытый артериальный проток;
- дефект межжелудочковой перегородки;
Незакрывшиеся отверстия в предсердной перегородке могут представлять собой и варианты недоразвития одной из ее частей. В любом случае, один или множественные дефекты обуславливают нарушения гемодинамики внутри сердца. Давление крови в левом предсердии выше давления в правом предсердии на 8-10 мм.рт.ст. При наличии дефекта оно может выравниваться, либо приближаться к равному. Происходит заброс крови через шунт слева направо, что провоцирует увеличение легочного кровотока и перегрузку правого желудочка, при этом выраженность патологических изменений напрямую зависит от размера дефекта в предсердной перегородке и податливости желудочков.
Так как в первое время жизни толщина стенок желудочков одинакова, то в период диастолы они растягиваются равномерно, патологический сброс небольшой. С возрастом растет и уменьшение сосудистого сопротивления, а через шунт сбрасывается все более значительное количество крови.
Правые отделы сердца из-за хронической перегрузки увеличиваются в размерах, но даже на данном этапе симптомов патологии может не быть. Только появление признаков легочной гипертензии (обычно к 2-3 годам и старше), а также сердечной недостаточности вызывает развитие симптоматики (чем крупнее дефект, тем раньше наблюдаются патологические признаки у ребенка).
Многие ДМПП спонтанно закрываются в первые годы жизни (речь идет о дефектах небольшого размера — до 2-5 мм.). Кроме подразделения по размеру, отверстия в межпредсердной перегородке классифицируются следующим образом:
- Первичный дефект, расположенный в нижней трети перегородки. Такие отверстия локализованы вблизи атриовентрикулярных клапанов, которые деформированы, либо наблюдается их дисфункция. Первичные дефекты представляют собой аномалии развития эндокардиальных подушечек. Изредка у взрослых возникает синдром Лютембаше — комбинация ДМПП с приобретенным стенозом митрального клапана , который возникает на фоне перенесенного ревматизма.
- Вторичный дефект, находящийся в верхней части перегородки или зоне овальной ямки (до 80% от всех ДМПП). Такие дефекты не следует путать с заболеванием «незаращение овального отверстия», которое, при малых размерах, вообще не влияет на продолжительность жизни и гемодинамику. Вторичные дефекты чаще всего сочетаются и с другими пороками сердца, с аневризмами. К группе вторичных ДМПП также относится редкий дефект венозного синуса.
Причины дефекта межпредсердной перегородки
Образование ДМПП связано с различными нарушениями в развитии плода в эмбриональном периоде. Эти нарушения касаются недоразвития частей межпредсердной перегородки и эндокардиальных валиков. Несмотря на то, что многие случаи дефектов являются спорадическими, есть множественные данные наследственной передаче патологии в тех семьях, где мать, отец или ближайшие родственники уже имели ВПС. Нередко ДМПП как семейные случаи появляются в комбинации с атриовентрикулярной блокадой, либо с недоразвитием костей кистей (синдром Холта-Орама).
Влияние тератогенных факторов на плод также может привести к развитию патологии. К ним относятся:
- инфекции у беременной женщины, перенесенные ею в первом триместре беременности — краснуха, ветрянка, цитомегаловирус, грипп, герпес, сифилис и многие другие;
- острые лихорадочные состояния;
- наличие нескорректированных эндокринопатий, особенно, сахарного диабета;
- прием лекарств, обладающих токсическим действием на плод;
- рентгеновское обследование матери, попадание под воздействие ионизирующей радиации;
- ранний токсикоз вплоть до угрозы выкидыша;
- работа матери на вредном производстве;
- прием алкоголя, наркотиков;
- неблагоприятная экология в месте проживания.
Привести к появлению множественных пороков сердца, а также аномалий развития этого органа вкупе с другими нарушениями в организме могут хромосомные мутации, случающиеся при зачатии. Так, дефект предсердной перегородки может становиться частью тяжелых генетических заболеваний — синдрома Гольденхара, синдрома Вильямса, синдрома Эллиса-Ван Кревельда и многих других.
Симптоматика болезни

Данный порок сердца имеется у ребенка с самого рождения. Тем не менее, его симптомы появляются намного позже — через несколько недель, месяцев, либо даже лет. При прослушивании сердца в родильном доме, как правило, отклонений не обнаруживается. Только позже появляется характерный шум в сердце, который, впрочем, может быть и очень слабым или не слышен вообще. Отсутствие симптоматики нередко приводит к позднему распознаванию порока, когда у ребенка уже имеются серьезные осложнения.
Чем больше размер отверстия в предсердной перегородке и меньше величина сопротивления легочной артерии, тем быстрее появляется клиническая картина ДМПП. Обычно ребенок до определенного возраста растет и развивается наравне со сверстниками, но затем становятся заметны первые признаки — более скорая утомляемость и непереносимость высоких физических нагрузок. Но когда данной порок сердца сочетается с другими ВПС, а нарушения гемодинамики более значимы, симптоматика может быть и ранней, и более явной. В целом, возможны следующие составляющие клиники заболевания:
- тахикардия;
- чувство сердцебиения;
- одышка при напряжении;
- формирование «сердечного горба»;
- усиление пульсации правого желудочка и легочной артерии;
- шумы в сердце;
- цианоз (как правило, выражен слабо);
- стойкая бледность кожи;
- холодность конечностей;
- слабость;
- головокружения, склонность к обморокам;
- увеличение размеров печени.
У 5% детей с вторичным пороком предсердной перегородки уже к году возникает тяжелая сердечная недостаточность, что, как правило, связано с наличием крупного дефекта венозного синуса. У таких больных всегда имеется отставание в физическом развитии, а порой и — сопутствующие пороки и аномалии других органов из-за существования генетических синдромов. При отсутствии операции на сердце большинство из этих больных умирает в раннем возрасте. Возможен еще один неблагоприятный исход заболевания, когда оно протекает бессимптомно многие годы и проявляется эмболическим инсультом у больного, что нередко случается во время беременности у женщин с ВПС.
Возможные осложнения
Как правило, без устранения дефекта на фоне гиперволемии малого круга кровообращения часто возникают респираторные заболевания — бронхиты, пневмонии, которые длительно не поддаются лечению, сопровождаются сильным кашлем с влажными хрипами и одышкой. Изредка может наблюдаться кровохаркание. Как правило, к 20-ти годам у больного начинают появляться осложнения:
- легочная гипертензия — перегрузка правой части сердца, возникновения застоя в легочном круге и повышения в нем давления;
- сердечная недостаточность — нарушение работы сердца в части его насосной функции, в результате чего орган не справляется с обеспечением тканей кислородом;
- аритмии — изменения сердечного ритма вплоть до тех, что угрожают внезапной остановкой сердца ;
- синдром Эйзенменгера — необратимые изменения в легких на фоне легочной гипертензии;
- парадоксальная эмболизация — проход тромбов из вен через имеющийся в предсердной перегородке дефект;
- тромбоэмболия — формирование и отделение тромбов от стенок сосудов и закупорка ими жизненно важных артерий — легочной, церебральных. Подробнее о диагностике и признаках тромбоэмболии на экг
Предотвратить эти последствия и следующую за ними инвалидность и смерть способно только лишь своевременное хирургическое вмешательство.
Проведение диагностики
Способы диагностики заболевания у детей и взрослых следующие:
- ЭКГ. Имеются признаки увеличения правого предсердия и правого желудочка, их перегрузка, если у больного уже возникает легочная гипертензия. Может выявиться резкое отклонение электрической оси влево из-за смещения уменьшенной ветви левой ножки пучка Гиса . При осложнениях на кардиограмме встречаются признаки атриовентрикулярной блокады , слабости синусового узла. При дефекте венозного синуса появляется нижнепредсердный ритм.
- Рентгенография грудной клетки. Есть усиление легочного рисунка, расширенность корней легких, выбухание правого предсердия, более выраженная пульсация легочных корней.
- УЗИ сердца с допплерографией (у взрослых — чреспищеводная ЭхоКГ). Обнаруживаются гипертрофия, дилатация левых отделов, при легочной гипертензии — также и правых отделов сердца. Может быть визуально заметен собственно дефект межпредсердной перегородки (на данном этапе его дифференцируют с открытым овальным окном). Проводится анализ наличия сопутствующих пороков и аномалий, оценивается степень сброса крови.
- Катетеризация сердца (зондирование его полостей). Показана перед операцией по поводу устранения порока сердца, а также при подозрении на легочную гипертензию при противоречивых данных других обследований. При катетеризации выполняют пробу с ингаляцией кислорода и пробу с аминофиллином, которые позволят оценить степень обратимости легочной гипертензии.
- Ангиография, МРТ-ангиография. Как правило, эти методы требуются для выявления аномального дренажа вен легких и дисфункции желудочков как сопутствующих ДМПП патологий.
ДМПП следует дифференцировать с дефектом межжелудочковой перегородки, триадой Фалло, аномальным дренажем легочных вен, открытым артериальным протоком и другими пороками сердца, а также их комбинацией. Вторичные дефекты предсердной перегородки следует также отличать от функционального систолического шума в сердце, незаращения овального отверстия.
Когда нужно срочно обратиться к врачу
В том случае, если ДМПП не был диагностирован в раннем возрасте, родители могут вообще не подозревать о его существовании. Нередко врачи рекомендуют повременить с операцией до определенного возраста малыша (как правило, вмешательства делают после 3-4 лет), и он продолжает жить и расти с имеющимся дефектом в предсердной перегородке. В любом случае, нужно срочно обратиться к врачу при появлении следующих симптомов у ребенка:
- посинение кожи;
- резкое усиление утомляемости, слабость;
- одышка;
- отеки руки и ног;
- аномальное сердцебиение;
- нарушения пульса;
- боли в области сердца.
Эти признаки отражают развитие той или иной степени сердечной недостаточности , в связи с чем операцию, возможно, придется выполнять раньше намеченного срока.
Методы лечения
Дефекты менее 3 мм. в диаметре часто закрываются самостоятельно. Обычно это происходит к 1,5 годам возраста ребенка. Что касается первичных дефектов, а также дефектов венозного синуса, они никогда не закрываются самопроизвольно. Обычно без операции к 20-30 годам возникает легочная гипертензия и сердечная недостаточность, но это может происходить и намного раньше. Поэтому операция показана всем больным с ДМПП, но не раньше, чем в 3-5 лет. Показания к более скорому выполнению вмешательства следующие:
- гиперплазия отделов сердца;
- рецидивирующие пневмонии;
- увеличение стенок легочной артерии;
- серьезная задержка физического развития;
- прогрессирование сердечной недостаточности;
- наличие сопутствующих пороков сердца.
До операции детям показано регулярное наблюдение у кардиолога и выполнение курсов медикаментозного лечения:
- диуретики при отеках, симптомах нарушения легочного кровообращения;
- бета-блокаторы для снижения давления, устранения нарушений ритма сердца;
- тромболитики для понижения свертываемости крови для недопущения угрозы тромбообразования;
- сердечные гликозиды для расширения сосудов и увеличения объема выталкиваемой сердцем крови.
Существует несколько видов операций, которые в настоящее время применяются при ДМПП. Выбор конкретной методики зависит от размера дефекта и его типа. Есть два основных вида операций и множество их разновидностей:
- пластика (заплатка из перикарда или синтетической ткани) или ушивание дефекта при создании условий искусственного кровообращения;
- окклюзия дефекта устройством Амплатцера и другими устройствами (обычно используется при малых размерах отверстия и его правильной форме).
Обычно при раннем выполнении операции в детском возрасте осложнения встречаются не более, чем в 1-4% случаев (тромбозы, перфорация стенки сосуда, АВ-блокада и т.д.), летальность не превышает 0,1%. Как правило, дилатация камер сердца подвергается обратному развитию после устранения дефекта. Во взрослом возрасте даже после операции могут сохраняться имеющиеся осложнения — легочная гипертензия, аритмии.
Образ жизни при данной патологии

После операции и до ее выполнения ребенку нельзя заниматься профессиональным спортом, строго запрещены физические перегрузки, тяжелый труд. В первые недели от проведения вмешательства следует носить специальный бандаж, который не даст швам разойтись, соблюдать постельный режим, а затем нужно начинать понемногу двигаться, глубже дышать. Нельзя принимать душ и ванну, пока швы полностью на заросли, а только аккуратно протирать тело влажной губкой.
При пороках сердца следует обязательно придерживаться здорового образа жизни, правильно питаться. Нужно по возможности не допускать респираторных патологий в первый год после вмешательства, а также до его выполнения. Умеренные физические нагрузки показаны всем прооперированным пациентам — гимнастика, прогулки, плавание и т.д. У кардиолога после операции желательно наблюдаться раз в год до конца жизни. Нельзя забывать принимать все лечебные и профилактические средства, которые назначил врач.
Беременность и роды
Малые размеры ДМПП у женщины обычно позволяют ей выносить и родить ребенка без проблем. Но при уже имеющихся осложнениях в виде легочной гипертензии , сердечной недостаточности, аритмии, при крупных размерах дефекта может возникнуть опасное для жизни матери и плода состояние при гестации, ведь нагрузка на сердце в этот период серьезно возрастает. Именно поэтому кардиологи настоятельно рекомендуют проводить хирургическое лечение в детском или подростковом возрасте, либо планировать беременность после прохождения курса консервативной терапии. В любом случае, следует наблюдаться у специалиста, а также на раннем сроке выполнять УЗИ сердца плода для обнаружения несовместимых с жизнью или сочетанных пороков, которые могут быть обусловлены отягощенной наследственностью.
Прогноз патологии
Прогностический расчет основывается на сроках проведения операции и наличии возникших до ее выполнения осложнений. Без операции в раннем детском возрасте течение болезни в 95% случаев доброкачественное. Тяжелые нарушения кровообращения и смерть в первый год жизни наблюдаются редко. Без лечения средняя длительность жизни — 40 лет, 15% больных погибает до 30 лет. Около 7% доживает до 70 лет, но уже к возрасту 45-50 лет становится инвалидами.
При устранении дефекта в детстве риск осложнений мал, больные, как правило, проживают полноценную жизнь.
В некоторых случаях все-таки возможно развитие различных видов аритмии в возрасте 45-60 лет. При оперативном закрытии дефекта после 20-25 лет высок риск сокращения продолжительности жизни из-за наличия необратимой легочной гипертензии и сердечной недостаточности.
Определение
Дефект межпредсердной перегородки-врожденный порок сердца, при котором есть сообщение между двумя предсердиями, развивающееся в результате аномального развития первичной и вторичной межпредсердных перегородок и эндокардиальных подушек.
Дефект межпредсердной перегородки в сочетании со стенозом левого атриовентрикулярного отверстия носит название синдрома Лютамбаше.
Эпидемиология
Распространенность дефекта межпредсердной перегородки составляет 5-10% всех врожденных пороков, является наиболее частым пороком сердца у взрослых (30%), у женщин отмечают чаще, чем у мужчин (2:1).
Патологическая анатомия
Существует несколько морфологических типов дефекта межпредсердной перегородки. Наиболее частый вариант - высокий дефект межпредсердной перегородки типа ostium secundum (75% случаев), возникающий вследствие нарушения развития вторичной перегородки, локализуется в центральной части межпредсердной перегородки в области овальной ямки (рис. 3.3).
Дефект типа ostium primum (15%) представляет собой вариант дефекта эндокарда, возникает вследствие неполного развития первичной перегородки, располагается в нижнем отделе перегородки непосредственно над уровнем предсердно-желудочковых отверстий, сочетается с расщеплением створок митрального и реже трехстворчатого клапанов.
Сочетание нарушения развития перегородок предсердия с неправильным расположением венозного синуса приводит к образованию сложных дефектов.
Дефекты венозного синуса (10%) чаще отмечают высоко в межпредсердной перегородке вблизи от впадения верхней полой вены, связаны с атипичным впадением легочных вен в правое предсердие или верхнюю полую вену. Намного реже дефекты венозного синуса могут локализоваться в нижней части перегородки над устьем нижней полой вены.
В некоторых случаях отмечают общее предсердие - отсутствие большей части межпредсердной перегородки или наличие только рудиментарных ее элементов, часто сочетается с расщеплением атриовентрикулярных клапанов.
Открытое овальное отверстие, которое не закрывается у 20% взрослых, не следует рассматривать как разновидность дефекта межпредсердной перегородки, поскольку при истинном дефекте имеется недостаточность ткани, а при открытом овальном окне сообщение осуществляется за счет клапана, который открывается при особых обстоятельствах.
Синдром Лютамбаше морфологически характеризуется наличием дефекта межпредсердной перегородки (чаще вторичного) и сужения левого атриовентрикулярного отверстия (врожденного или приобретенного). Характерным является расширение ЛА, которая иногда вдвое превышает размер аорты.
Нарушения гемодинамики
Наличие дефекта межпредсердной перегородки приводит к сбросу артериальной крови из левого предсердия в правое вследствие наличия градиента давления между ними. В результате возникает перегрузка объемом правой половины сердца, дилатация ПЖ и увеличение ОЦК в малом круге. При больших дефектах это может приводить к легочной гипертензии, однако выраженная гипертензия в малом круге в первые 20 лет возникает у около 2% больных.
Основную роль в компенсации нарушения кровообращения играет ПЖ, работа которого увеличивается в несколько раз. Недостаточность ПЖ развивается после 10 лет существования порока, в более старшем возрасте присоединяется недостаточность ЛЖ. Последняя, вызывая уменьшение его податливости, может приводить к увеличению объема шунта слева направо.
При синдроме Лютамбаше величина шунта увеличивается пропорционально возрастанию стенозирующего дефекта митрального отверстия, помимо этого происходит нарушение оттока крови из малого круга и возникновение легочной гипертензии.
Клиническая картина
Клинические проявления порока зависят от степени нарушения гемодинамики и изменяются с возрастом. При относительно небольшом дефекте в молодом возрасте больные могут не предъявлять жалоб и порок выявляют при случайном обследовании. Жалобы на одышку и приступы сердцебиений при физической нагрузке возникают в возрасте старше 40 лет, затем нарастают слабость и утомляемость, появляются различные аритмии, СН, которая обусловлена выраженной легочной гипертензией.
При больших дефектах межпредсердной перегородки одышка является одним из симптомов заболевания уже в молодом возрасте. У больных часто возникают приступы сердцебиения.
При перкуссии отмечают расширение границ сердца преимущественно вправо, а при больших дефектах - влево. В отдельных случаях описаны наличие сердечного горба (за счет увеличения правых отделов сердца), а также систолическое дрожание у левого края грудины.
Характерна аускультативная картина: над ЛА слева у грудины выслушивается систолический шум умеренной интенсивности, возникающий вследствие увеличенного кровотока через клапан ЛА. Второй тон над ЛА усилен и раздвоен. Реже определяют диастолический шум над нижней частью грудины, связанный с относительным стенозом отверстия трехстворчатого клапана при увеличенном количестве крови, проходящей через него. После того как возросшее легочное сосудистое сопротивление приводит к понижению величины сброса крови слева направо, интенсивность шумов снижается, появляется диастолический шум, вызванный недостаточностью клапана ЛА.
Диагностика
На ЭКГ электрическая ось сердца у больных со вторичным дефектом отклонена вправо, с первичным - влево. При каждом из дефектов выявляют различную степень перегрузки и гипертрофии ПЖ и правого предсердия, выраженность которой зависит от величины давления в легочном стволе. Выявляют признаки частичной блокады правой ножки пучка Гиса (феномен rSR"или rsR" в правых грудных отведениях), могут определять предсердную экстрасистолическую аритмию, пароксизмальную суправентрикулярную тахикардию. У больных с синдромом Лютамбаше нередко выявляют фибрилляцию предсердий.
На рентгенограмме сердце увеличено в поперечнике, в косых проекциях определяется увеличение правых отделов сердца. Дуга ЛА выбухает, дуга аорты уменьшена, усилен сосудистый рисунок легких, корни легких расширены, характерна их пульсация.
Диагноз устанавливают методом трансторакальной и допплеровской эхо КГ, с помощью которой можно установить локализацию, размер дефекта (хорошо визуализируются оstium secundum и primum), а также направление сброса крови. При эхоКГ-исследовании выявляют следующие признаки:
Увеличение полости правого предсердия и ПЖ;
Парадоксальное движение межжелудочковой перегородки;
Гипердинамичное движение стенок левого предсердия;
Признаки легочной гипертензии;
Признаки расщепления митрального и трехстворчатого клапанов с проявлениями их недостаточности при первичном дефекте (рис. 3.4);

Пролапс митрального клапана при вторичном дефекте;
Стеноз митрального отверстия при синдроме Лютамбаше;
Шунтирование крови между предсердиями слева направо или справа налево (рис. 3.5а, б).
Дефекты венозного синуса требуют дополнительных диагностических подходов - чреспищеводная эхоКГ обеспечивает наилучшую визуализацию межпредсердной перегородки, легочных вен, особенно у взрослых пациентов с недостаточными «акустическими окнами».

В-режим: а) субкостальная позиция, длинная ось; б) апикальная четырехкамерная позиция, шунт слева направо (левое предсердие - правое предсердие)
Катетеризации полостей сердца обычно не требуется, кроме случаев сопутствующей легочной гипертензии или когда неинвазивное исследование неполноценно. Наличие дефекта межпредсердной перегородки подтверждается проведением катетера из правого предсердия через перегородку в левое и повышением насыщения крови кислородом в полости правого предсердия по сравнению с пробами крови, взятой у устья полых вен. Разница в 2 об.% и более (или 8-10%) рассматривается как абсолютный признак шунтирования крови.
Коронароангиографию обычно проводят пациентам в возрасте старше 40 лет перед планируемой хирургической коррекцией порока.
Дефект межпредсердной перегородки также может быть диагностирован с помощью КТ (рис. 3.6) или МРТ, которая является методом выбора для оценки внесердечной анатомии, в том числе больших сосудов, ветвей ЛА, также как и системных и легочных венозных соединений.

Рис. 3.6.
Мультиспиральная КТ, апикальный срез
Хирургическое закрытие дефекта рекомендовано, если соотношение легочного к системному кровотоку более чем 1,5:1 и отношение легочного к системному сосудистому сопротивлению менее 0,7. Нет единого мнения относительно хирургического лечения асимптомных больных в возрасте 25-40 лет, однако оно оправдано для предупреждения прогрессирования симптомов. Вследствие возможности увеличения сброса крови слева направо, появления фибрилляции предсердий и развития легочной гипертензии с возрастом желательно выполнение хирургической коррекции порока до появления признаков ухудшения функции сердца. У симптомных больных в возрасте старше 40 лет хирургическое закрытие дефекта улучшает толерантность к физической нагрузке и выживаемость по сравнению с медикаментозной терапией и предотвращает дальнейшее ухудшение функционального состояния, хотя не снижает риск развития суправентрикулярной аритмии, СН и цереброваскулярных событий. Хирургическое вмешательство у 80% больных старше 60 лет со значительным сбросом крови приводит к улучшению симптомов. У 70% больных старшего возраста после операции сохраняются нарушения ритма, у 10-25% они возникают впервые, повышается риск системной АГ неясной этиологии.
Показания к хирургическому лечению
Неэффективная медикаментозная терапия СН;
Значительный артериовенозный сброс;
Отставание в физическом развитии;
Повышение давления в малом круге кровообращения.
Противопоказания к оперативному вмешательству
1. Веноартериальный (справа налево) сброс, поскольку это признак выраженной гипертензии и часто необратимых изменений в малом круге кровообращения.
2. Выраженная левожелудочковая недостаточность.
Хирургическое лечение заключается в ушивании или пластике заплатой дефекта межпредсердной перегородки. Мелкие дефекты зашивают, большие закрывают гомотрансплантатами или протезами из пластмассовой губки. При первичном дефекте со значительной митральной недостаточностью дополнительно ушивают расщепленную створку или проводят протезирование митрального клапана. В результате хирургического лечения улучшается состояние больного: уменьшаются одышка, сердцебиение, размеры сердца.
В последние годы возрастает роль устройств для закрытия дефекта (впервые применены в 1976 г.), выбор типа устройства зависит от локализации дефекта. В настоящий момент нет сравнительных исследований между внедрением устройств и хирургическими методами операции, не существует консенсуса по длительному наблюдению после установки устройств и долговременные исходы неизвестны, включая риск развития предсердной аритмии, СН и инсульта, предполагается, что исход будет сопоставим.
При синдроме Лютамбаше хирургическое лечение заключается в одномоментной коррекции - устранении дефекта межпредсердной перегородки и митральной комиссуротомии. Противопоказаниями к операции служат лишь тяжелая стадия легочной гипертензии и резко выраженная дистрофия миокарда, обусловливающая терминальную стадию СН.
Медикаментозная терапия включает симптоматические средства: антиаритмические препараты при фибрилляции предсердий и пароксизмальной суправентрикулярной тахикардии, лечение СН.
Вторичный дефект имеет благоприятное естественное течение в первые 20-30 лет жизни. Причиной смерти при отсутствии оперативной коррекции является правожелудочковая СН, реже - тромбоз ЛА, аритмия. При первичном дефекте течение менее благоприятное, прогноз хуже, раньше возникают клиническая симптоматика и осложнения, основным отягощающим фактором является легочная гипертензия.
